Obsah:
| Fixační činidla Jak již bylo řečeno v předchozím odstavci, výběr fixačního činidla má velký vliv na konečný výsledek, kterým je pozorovaná buněčná ultrastruktura preparátu. Z tohoto důvodu se v přípravě preparátů pro TEM používají při chemické fixaci téměř výhradně aditivní fixační činidla, která můžeme zhruba rozdělit do dvou skupin: Aldehydy - látky, které charakterizuje přítomnost aldehydické skupiny - CH=O v jejich molekule. Vyznačují se obecně štiplavým zápachem a velkou reaktivitou, přičemž mají výrazné redukční vlastnosti. Ve vodných roztocích jsou nestálé, na světle a při pokojové teplotě se aldehydická skupina oxiduje vzdušným kyslíkem za vzniku příslušné karboxylové kyseliny: 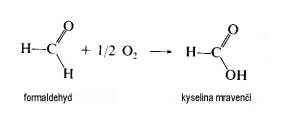 Kromě toho mají tendenci polymerizovat ve vodných roztocích za vzniku cyklických či lineárních forem, v důsledku čehož roztoky ztrácejí reaktivitu a snižuje se v nich koncentrace účinné monomerní složky. Při fixaci reagují rychle hlavně s aminoskupinami aminokyselin a dalších sloučenin za vzniku tzv. Schiffových bází: 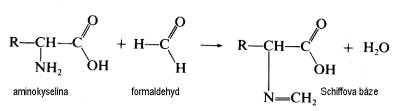 V literatuře jsou popsané různé typy adičních a kondenzačních reakcí aldehydů se skupinami -SH a -CONH , dále s fenolovými a imidazolovými deriváty a řadou jiných sloučenin. Při těchto reakcích se aldehyd váže na jednu z uvedených skupin, v případě dvou funkčních aldehydických skupin se může navázat na dvě skupiny jedné molekuly nebo může navzájem propojit dvě různé molekuly. Po fixaci aldehydy si buňky zachovávají zčásti svoji enzymatickou a imunologickou aktivitu, takže lze použít cytochemické a imunologické metody na lokalizovaní příslušných enzymů, proteinů a sacharidů v jejich ultrastruktuře. Většinou platí, že čím lepší fixace a tedy dobře zachovaná ultrastruktura, tím menší možnost lokalizace buněčných komponent. V současné době se při přípravě preparátů pro TEM nejvíce používají tři zástupci této skupiny: glutaraldehyd, formaldehyd a akrolein Glutaraldehyd (dále GA) - obsahuje dvě aldehydické skupiny OHC-(CH2)3-CHO, díky kterým je schopen se zároveň vázat ke dvěma funkčním skupinám a tak vytvářet můstky, např. mezi dvěma bílkovinnými molekulami. Komerčně se prodává jako vodný, čirý roztok, štiplavého zápachu, s koncentrací až 70 %. Při vyšší koncentraci je však nestálý a roztok obsahuje velké množství degradačních produktů, jako kyselinu glutarovou, akrolein, etanol, oligomery a polymery glutaraldehydu, které sice nemusí v určité kombinaci nepříznivě ovlivnit fixaci, ale roztok je značně nestandardní a fixace nereprodukovatelná. V důsledku těchto reakcí se snižuje jeho pH a pokud klesne pod hodnotu 3, zvýšený obsah kyseliny glutarové by již měl nepříznivý vliv na kvalitu fixace a roztok je třeba přečistit. K tomu účelu se používá vakuová destilace, iontoměniče nebo čištění roztoku pomocí aktivního uhlí (Protokol č.1). Čistota roztoku GA se kontroluje spektrofotometricky (obr. 1), kde nečistoty zvyšují vrchol absorbance při 235 nm. Aby byl roztok použitelný k fixaci, musí poměr P/M být v intervalu 0,1 - 0,15. Po přečištění je třeba stanovit aktuální koncentraci glutaraldehydu v roztoku jodometrickou titrací (Protokol č.2). Při fixaci GA reaguje převážně s peptidy a bílkovinami. Rychle reaguje především s aminoskupinami lysinu. Většina bílkovin začne po styku s GA do 30 s vytvářet průzračné gely, ale dokončení reakce je pomalé a trvá několik hodin. Z ostatních sloučenin reaguje přímo s kyselinou deoxyribonukleovou. Nereaguje s lipidy, některými polysacharidy a proteoglykany. Membrány si po fixaci GA zachovávají své permeabilní vlastnosti. V průběhu fixace se spotřebovává kyslík, jeho nedostatek v roztoku vede ke zpomalení fixace a snížení její kvality. Proto např. provzdušňování roztoku či přídavky látek uvolňujících kyslík (peroxid vodíku) zlepšují konečné výsledky fixace. Na rozdíl od formaldehydu, GA má výrazně nižší penetrační rychlost, která je navíc ovlivněna řadou parametrů: teplotou fixačního roztoku, jeho složením a osmolalitou, strukturou a charakterem fixovaného vzorku, způsobem fixace, promícháváním roztoku apod. Udává se, že rychlost pronikání GA do tkáně je v rozmezí 0,2 až 0,34 mm/hod, což znamená, že do středu preparátu o velikosti 1 mm3 se GA dostane za 1,5 až 2,5 hod. Proto je třeba udržovat velikost fixovaného materiálu v rozumných mezích a v případě větších vzorků v jejich středu očekávat častější výskyt artefaktů. Formaldehyd (dále FA)- na rozdíl od ostatních aldehydů používaných k fixaci je za pokojové teploty plynem se štiplavým zápachem, dobře rozpustným ve vodě. Má jednu aldehydickou skupinu H-CHO, kterou se váže na aminoskupiny bílkovin. Díky své malé molekule se vyznačuje vysokou penetrační rychlostí, takže je s ním možné fixovat i preparáty větších rozměrů. Kvalita výsledné fixace je nižší než v případě GA, proto se často využívá kombinace obou aldehydů, kdy přítomnost FA zaručuje rychlou a GA kvalitní fixaci (Protokol č.3). Komerčně se prodává jako vodný roztok s koncentrací do 40%, ve kterém jsou přítomné jak degradační produkty (polymer formaldehydu a metanol), tak stabilizátor, které obojí zhoršují kvalitu fixace. Proto se k přípravě preparátů pro elektronový mikroskop používá čerstvých roztoků připravených těsně před použitím depolymerizací paraformaldehydu. Vzhledem k nižší kvalitě výsledné ultrastruktury se v současné době FA používá většinou ke speciálním účelům, např. k přípravě preparátů pro následné imunoznačení, neboť lépe zachovává antigenicitu preparátu. Akrolein - aldehyd s jednou funkční skupinou CH2 =CH-CHO, který se dříve používal jako slzný plyn. Je toxický, dráždí sliznice nosu, dýchacích orgánů, oči, kůži apod. Navíc je velmi hořlavý a chemicky velmi reaktivní . Se vzduchem v poměru 2,8 - 31 % tvoří výbušnou směs. Z těchto jeho vlastností vyplývá, že práce s ním je bez dobře fungující digestoře takřka nemožná a není proto příliš vyhledávaným fixačním činidlem. Komerčně se dodávají roztoky stabilizované malým množstvím hydrochinonu, který inhibuje samovolnou oxidaci a polymerizaci. Při fixaci akrolein reaguje téměř identicky jako GA, ale rychlost reakcí je mnohem vyšší. Kvalita fixace kolísá v závislosti na stavu roztoku a množství degradačních produktů. Právě jeho nestabilita brání jeho většímu rozšíření spolu s jeho toxicitou a z ní plynoucích problémů při manipulaci. Oxidační činidla - tvoří druhou velkou skupinu látek, které se používají při fixaci. Zástupci této skupiny jsou oxid osmičelý, oxid ruteničelý a manganistan draselný. Oxid osmičelý - OsO4 , Mr = 254,2, za pokojové teploty se vyskytuje ve formě průsvitných krystalků nažloutlé barvy. Je velmi těkavý a jeho páry mají dráždivý a leptavý účinek na sliznice dýchacích cest, oči a kůži. Proto k manipulace s OsO4 a jeho vodnými roztoky, které se používají k fixaci, je nezbytná dobře fungující digestoř. OsO4 má silné oxidační účinky, přičemž se sám redukuje a tvoří sloučeniny, v nichž má nižší mocenství. Při reakci s organickými sloučeninami vzniká tzv. osmiová čerň (OsO2 . n H2O), která způsobuje zčernání preparátů po fixaci OsO4 .K fixaci se nejčastěji používají 1-4% vodné roztoky OsO4, které jsou dostatečně stabilní. V přítomnosti pufru, při pH vyšším než 7, se osmiové ionty redukují a tím snižuje se reaktivita fixačního roztoku: OsO4 + 2OH = [OsO4 (OH)2]2- = [OsO2 (OH)4]2- Tyto reakce se projeví změnou barvy roztoku, který nejprve zrůžoví, postupně tmavne a nelze ho již použít k fixaci. K fixaci je možné použít čirý roztok se světležlutým nádechem, který lze buď zakoupit anebo si ho připravit rozpuštěním krystalického OsO4 (Protokol č.4). Vzhledem k vysoké reaktivitě a těkavosti je dlouhodoběji možné roztok skladovat pouze zatavený ve skleněných ampulích (obr. 2). Kvalita fixace OsO4 je ovlivněna řadou parametrů, mezi něž patří teplota, pH roztoku, koncentrace apod. Z činidel, která se používají v průběhu přípravy preparátu, reaguje s etanolem, proto je třeba vzorek po fixaci a před odvodněním důkladně zbavit zbytků fixačního roztoku: OsO4 + C2H55 OH = OsO2 + 2 CH3CHO + 2 H2O Této reakci jsou připisovány densní precipitáty, které se občas objevují uvnitř tkáně a jejichž původ bývá těžko určitelný. Při fixaci OsO4 čile reaguje s a-aminokyselinami za vzniku a-ketokyselin a karboxylových kyselin. Při reakci se uvolňuje amoniak a klesá pH roztoku: 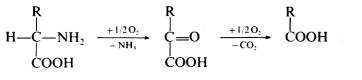 Velmi ochotně reaguje OsO4 s dvojnými vazbami olefinových uhlovodíků a mastných kyselin za vzniku komplexů nižších oxidů osmia, např. cyklické estery, diestery apod.: 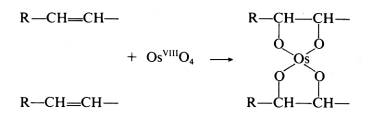 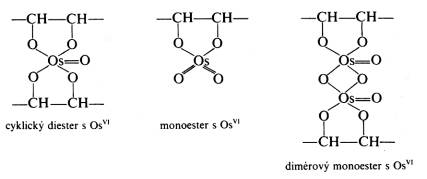 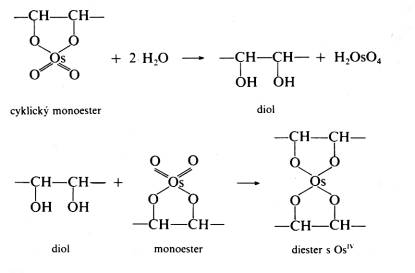 Důsledkem těchto reakcí je vynikající fixace membrán a jejich zvýraznění v buněčné ultrastruktuře, protože navázané atomy osmia působí díky svému vysokému atomovému číslu jako kontrastující činidlo a dobře rozptylují procházející primární elektrony (obr. 3). Naproti tomu nereaguje OsO4 s glycidy a nedenaturovanou DNK a dalšími buněčnými komponentami, takže se v současné době používá jako sekundární fixační činidlo po primární aldehydové fixaci. Při této kombinaci je ultrastruktura daného vzorku většinou nejlépe zachována (tab.1). Nevýhodou OsO4 je jeho vysoká cena, kterou je možné snížit sléváním použitých fixačních roztoků a jejich opětnou recyklací (Protokol č.5). Oxid ruteničelý - je ve velmi blízký svým fixačním účinkem OsO4 , navíc je ještě reaktivnější a pro fixaci proto postačí roztoky s nižší koncentrací. Vzhledem ke své reaktivitě se používá pouze ve speciálních případech většinou k postfixaci po primární aldehydové fixaci. Manganistan draselný - silné oxidační činidlo, které reaguje s podobnými sloučeninami jako OsO4. Při fixaci výrazně poškozuje proteiny, způsobuje fragmentaci a destrukci aminokyselin a dalších sloučenin. Výborně však fixuje fosfolipidové membrány a k těmto účelům někdy bývá využíván. |
| Další |
Obrázky | |
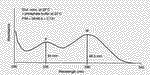 |
Obr.1 - Spektrofotometrická křivka roztoku glutaraldehydu |
| Zpět | |
 |
Obr.2 - Ampule s krystaly oxidu osmičelého a 8% GA, určené pro jejich dlouhodobé skladování |
| Zpět | |
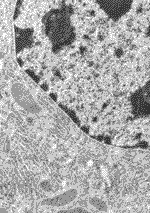 |
Obr.3 - Vliv postfixace OsO4 - Myší hepatocyt, bez postfixace OsO4, zalitý do LR Whitu |
| Zpět | |
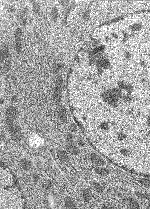 |
Obr.4 - Myší hepatocyt, postfixovaný OsO4, zalitý do Eponu |
| Zpět | |