Obsah:
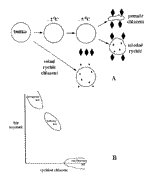
| Mrazící metody V současnosti zažívají obrovský rozvoj v biologické elektronové mikroskopii. Hlavním důvodem je skutečnost, že jsou schopny preparát zachovat co nejblíže nativnímu stavu bez cizorodých přídavků a že se řada přístrojů stala komerčně dostupnými , které spolehlivě a reprodukovatelně umožňují biologické objekty zmrazovat, krájet, sušit apod. Mrazová fixace - je stejně jako při použití chemického způsobu přípravy preparátů prvním a velmi důležitým krokem přípravy. Většina živých organismů obsahuje více než 70 % vody nerovnoměrně rozdělené do membránami ohraničených oblastí. Chceme-li tedy biologický vzorek dobře mrazově zafixovat, musíme vycházet především z vlastností vody, které jej tvoří. Při zmrazování voda vykazuje řadu anomálií, kterými se odlišuje od ostatních látek a které celý proces znesnadňují: - její objem ve zmrazeném stavu je zhruba o 9 % větší než v kapalném stavu - její hustota není nejvyšší v bodě tuhnutí, ale v kapalném stavu při teplotě 277 K - má anomálně vysoký bod tání (273 K), bod varu (373 K) a kritickou teplotu (647 K) - má vysoké vypařovací teplo a dielektrickou konstantu, která přispívá k její roli univerzálního rozpouštědla v biochemických reakcích - je známa řada krystalických forem ledu Tyto anomálie jsou do značné míry způsobeny přítomností intermolekulárních vazeb - vodíkových můstků a van der Waalsových sil. V praxi znamenají nebezpečí poškození ultrastruktury v důsledku potrhání buněk zvětšujícím se objemem nebo tvořícími se krystaly. Jak tedy vlastně voda mrzne? U velmi čisté vody je velmi nepravděpodobné, že zmrzne při 273 K a je ji možné podchladit bez tvorby ledu podle čistoty až k teplotě 235 K (-38 0C) při normálním atmosférickém tlaku. Při této teplotě náhodně začnou vznikat jednotlivé krystaly ledu, které pak fungují jako krystalizační zárodky. Při krystalizaci ledu se uvolňuje teplo, které ohřívá celý systém a udržuje jej v oblasti růstu krystalů. Tento děj se označuje jako homogenní nukleace a její průběh je znázorněn na přímce č. 1 v (obr. 1). Růst krystalů pokračuje až do dosažení rekrystalizační teploty zhruba při 138 K a pokud teplo uvolňované krystalizací není dostatečně rychle odváděno, jsou vytvořené krystaly relativně velké. U normální vody působí v roli krystalizačních zárodků nerozpustné částice a v tomto případě se jedná o heterogenní nukleaci. V biologických materiálech situace při mrazení není zdaleka tak průzračná jako v předchozích případech, protože buňky se skládají z řady kompartmentů ohraničených membránami, které obsahují směsy organických a anorganických vodných roztoků. Z experimentů je známé, že u buňky obsahující okolo 80 % vody dochází k zamrznutí při teplotě 233 K a rekrystalizační teplota je okolo 188 K, takže se poměrně výrazně zkrátí teplotní interval, při kterém mohou růst krystaly - viz přímka 2 v (obr. 1). Proces krystalizace ve vodných roztocích vždy přináší fázovou separaci, kdy rostoucí krystaly ledu stahují vodu z nezamrzlých oblastí, v důsledku čehož roste koncentrace zbylých roztoků. Tento proces pokračuje do chvíle, kdy celý systém dosáhne eutektické teploty a ztuhne. Fázová separace přináší během mrazení změny osmotického gradientu a pH, které vedou k redistribuci intra a extracelulárních roztoků a k destrukci membrán. Časový průběh procesu mrazení pro roztok soli je načrtnut na (obr. 2). Možností, jak zkrátit teplotní interval, při kterém dochází k růstu krystalů, je ošetřit vzorek před zmrazením kryoprotektantem - přímka 3 v (obr. 1). To jsou látky, které snižují teplotu homogenní nukleace, zvyšují rekrystalizační teplotu a snižují množství volné vody v systému. Rozdělují se do dvou skupin: - penetrující, o kterých se předpokládá, že pronikají do buněk a jejich kompartmentů, jako např. glycerol, dimethylsulphoxid a ethylen glycol - nepenetrující, které zůstávají vně buněk, např. polyvinylpyrolidon, sacharóza Použití kryoprotektantu však znamená přídavek cizorodé látky do vzorku a omezení jedné z výhod, kterou kryofixace přináší. Z uvedeného přehledu vyplývá, že základním podmínkou pro minimalizaci škod při mrazení preparátu je dostatečně vysoká rychlost odvodu tepla ze vzorku, tedy dosažení vysoké chladící rychlosti. V literatuře se uvádí, že pro kvalitní kryofixaci je nutná chladící rychlost minimálně 104 K/s-1. Pokud není této rychlosti dosaženo, je vzorek vystaven nebezpečí poškození, jak schematicky znázorňuje diagram na (obr. 3). Cílem kryofixace je dosáhnout vitrifikovaného stavu vzorku, kdy vzorek je zchlazen pod rekrystalizační teplotu bez vzniku krystalů. V porovnání s chemickou fixací má kryofixace i přes řadu technických omezení několik nesporných výhod: - buňky mohou být pozorovány v mikroskopu v jejich přirozeném extra a intracelulárním prostředí a to dokonce i v případě ultratenkých řezů, kdy zpevnění vzorku zmrazením je dostatečné pro jejich přípravu - nedochází při ní k denaturaci enzymů a antigenů - buňky jsou při kryofixaci imobilizovány ve zlomku vteřiny, což umožňuje i sledovat časově závislé, dynamické děje. Chladící média Od vhodného chladícího média očekáváme, že bude splňovat několik základních předpokladů: - dobrá tepelná vodivost a velká tepelná kapacita - vysoká tekutost při nízkých teplotách - vysoká hustota - bezpečné použití - nízká cena Všechny tyto požadavky nesplňuje ani jedna látka používaná k mrazení, jak udává {tab. 1} . Propan a etan, které vyhovují většině, jsou vysoce explozivní a práce s nimi je spojena s mimořádnou opatrností. Kapalný dusík, který je nejběžnějším laboratorním chladivem, má tu nevýhodu, že má velmi blízko bod tání a bod varu. Důsledkem toho je, že vhození i rozměrově nepatrného vzorku vede k varu kapalného dusíku na jeho povrchu spojeném s uvolňováním plynu, který vzorek obalí a izoluje. Sníží se tak rychlost odvodu tepla. Při použití kapalného dusíku je nezbytné vzorek ošetřit kryoprotektantem. Způsob mrazení O kvalitě mrazové fixace do značné míry rozhoduje způsob jejího provedení. Výběr závisí na řadě podmínek, z nichž nejdůležitější jsou jednoduchost, reprodukovatelnost, rychlost a finanční náročnost. Schematicky jsou jednotlivé způsoby znázorněny na (obr. 4). Imerzní kryofixace - vzorek, malý kousek tkáně připevněný na kovovém nosiči nebo koncentrovaná suspenze na síťce, je mechanicky nebo automaticky ponořen do kapalného chladiva. Pokud je použit kapalný propan nebo etan, lze tímto způsobem dosáhnout i vitrifikace vzorku. Při použití kapalného dusíku je pro dobrou kryofixaci nutné použít kryoprotektant. Sprejová metoda - je použitelná pouze pro suspenze buněčných frakcí, isolované buňky, viry apod., kdy malé kapičky suspenze jsou vstřikovány do chladícího média. Vzhledem k malému objemu vzorků jsou výsledky této metody výborné. Jet freezing - je vylepšená předchozí metoda, kdy se vzorek navíc pohybuje v chladícím médiu, takže nedochází k ohřátí média, které ho obklopuje, a je stále obklopen novým chladícím médiem s konstantní teplotou. Alternativou je, že vzorek je ve fixované pozici a kolem něj rychle proudí chladící médium. Tato metoda poskytuje vynikající výsledky. Mražení pomocí kovového zrcadla - podstatou metody je naražení vzorku na povrch kapalným dusíkem vychlazeného a vyleštěného kovového bloku. Výsledkem je tenká vrstva vzorku s dobře zmrazeným povrchem, který byl v kontaktu s povrchem kovového zrcadla (obr. 5). Aparaturu pro standardní a reprodukovatelné provádění tohoto způsobu mrazení dodává firma Leica (obr. 6) Mražení při vysokém tlaku - tato metoda vyžaduje speciální aparaturu (obr. 7), ve které dochází ke zmrazení vzorku za sníženého tlaku, takže k mrazení lze použít i kapalný dusík. Podle dostupné literatury poskytuje skvělé a reprodukovatelné výsledky. Zpracování zmraženého preparátu Po dobré kryofixaci je třeba vzorek dále zpracovat pro prohlížení v TEM. Možností se nabízí několik, jak dokládá schéma na (obr. 17). K moderním ultramikrotomům je možné zakoupit kryokomoru, ve které se dají připravovat ultratenké řezy při teplotách okolo -1000 C (obr. 8) a (obr. 9). Po přenesení řezů na síťku (obr. 10) jsme opět na křižovatce možností, jak postupovat dále. Pokud chceme zachovat všechny přednosti, které kryofixace přináší, bylo by nejlépe vzorek pozorovat přímo ve zmrazeném stavu. K tomuto účelu je však nezbytné mít TEM vybavený kryodržákem (obr. 11) a možností prohlížet preparáty v režimu minimálního ozáření urychlenými elektrony (low dose), aby nedocházelo k jejich zahřívání a k odpařování ledu z jeho povrchu. Další možností je po nakrájení kryořezy vysušit řízenou sublimací ledu a vysušeným vzorkům dodat kontrast stínováním (viz kap.6). Pro imunocytochemické účely se často používá metoda přípravy tzv. roztátých kryořezů, označovaná podle svého tvůrce Tokuyashu, kdy po přenesení řezů z kryokomory ultramikrotomu na kapce vhodného kryoprotektantu se nechají řezy roztát na hladině pufru. Po provedení imunoznačení se roztáté řezy zalijí do metylcelulózy a je možné je prohlížet v TEM. Jaký vliv má výběr kryoprotektantu pro přenos na výsledný vzhled řezu dokládá (obr. 12) a (obr. 13), kde je vidět výrazný rozdíl v zachování ultrastruktury jinak naprosto stejně připravovaného vzorku jaterní tkáně myši. Pokud není možné nakrájet zmrazený vzorek na ultratenké řezy, přichází do úvahy metoda označovaná jako mrazová substituce (freeze substitution). Při ní se ve zmrazeném stavu při teplotách v intervalu -750 až-800 C nahradí led ve vzorku organickým rozpouštědlem. A opět můžeme pokračovat několika směry. Pokud substituční médium obsahovalo rozpuštěné fixační činidlo, zvyšuje se postupně teplota až na hodnotu -200 C, kdy začnou aldehydy i oxid osmičelý reagovat s preparátem. Výhodou tohoto postupu je, že v okamžiku začátku reakce je vzorek fixačním činidlem rovnoměrně prosycený a kvalita fixace je v celém objemu vzorku stejná. Po fixaci je možné vzorek ohřát na pokojovou teplotu a dokončit přípravu tradičním způsobem. Nebo je možné pomocí akrylátových pryskyřic vzorek zalít při teplotě až do -500 C. Výborným pomocníkem při provádění těchto postupů je zařízení firmy Leica (obr. 14), které umožňuje řídit velmi pomalé změny teploty např. o několik stupňů za den. Další velmi často používanou metodou především při přípravě preparátů pro skanovací elektronový mikroskop je mrazové sušení. Preparáty určené pro TEM musí být v tomto případě velmi malé, rozprostřené na síťce potažené např. formvarem. Principem metody je sublimace ledu ze vzorku a pokud tento proces má probíhat pomalu a řízeně, nezbývá než zakoupit speciální zařízení určené k těmto účelům (obr. 15). Po vysušení je třeba zvýšit kontrast takto připraveného preparátu stínováním. Na závěr považuji za důležité zmínit i několik nevýhod kryopostupů. Patří k nim především problémy se skladováním zmrazených preparátů, kdy musí být zaručena teplota pod -800 C, protože jinak může dojít k rekrystalizaci ledu a poškození kvalitně zafixovaného materiálu, dále problémy s manipulací zmrazených vzorků a řezů a potřeba náročného technického vybavení. (obr. 16) přináší přehled teplot důležitých při používání kryometod. |
| Další |
Obrázky | |
 |
Obr.1 - schematické znázornění teplotních intervalů, ve kterých mohou růst krystaly, při mrazení 1-čisté vody, 2-vody v živých buňkách, 3-ošetřených kryoprotektantem, M-bod tání, R-rekrystalizační bod, S-podchlazení, Robards a Sleyter, 1985 |
| Zpět | |
 |
Obr.2 - schematické znázornění časového průběhu mrazení v zředěném roztoku soli |
| Zpět | |
 |
Obr.3 - schematické znázornění vlivu rychlosti mrazícího procesu na zachování buněčné ultrastruktury, Robards a Sleyter, 1985 |
| Zpět | |
 |
Obr.4 - schema různých mrazících metod |
| Zpět | |
 |
Obr.5 - vznik krystalů ledu ve vzorku zmrazeném metodou nárazu na vychlazený kovový blok |
| Zpět | |
 |
Obr.6 - zařízení firmy Leica pro mrazení preparátů nárazem na vychlazený kovový blok |
| Zpět | |
 |
Obr.7 - aparatura dodávaná firmou Leica k mrazení za vysokého tlaku |
| Zpět | |
 |
Obr.8 - Ultramikrotom Leica UCT s kryonástavcem FSC |
| Zpět | |
 |
Obr.9 - pohled do kryokomory s při přípravě kryořezů pomocí skleněných nožů |
| Zpět | |
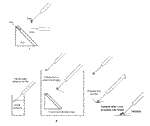 |
Obr.10 - schematické znázornění postupů při přenášení kryořezů A-určených pro přímou vizualizaci nebo mrazové sušení, B-určených k imunoznačení na roztátých řezech metodou Tokuyashu |
| Zpět | |
 |
Obr.11 - kryodržák k TEM Philips 420 |
| Zpět | |
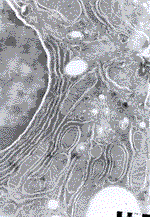 |
Obr.12 - ultrastruktura myšího hepatocytu, připraveného metodou Tokuyashu, kdy k přenosu řezů byla použita metylcelulóza |
| Zpět | |
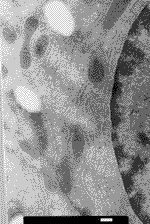 |
Obr.13 - ultrastruktura myšího hepatocytu, připraveného metodou Tokuyashu, kdy k přenosu řezů byla použita sacharóza |
| Zpět | |
 |
Obr.14 -aparatura firmy Leica pro provádění freeze substitution |
| Zpět | |
 |
Obr.15 - zařízení pro mrazové sušení a PLT od firmy Leica |
| Zpět | |
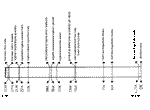 |
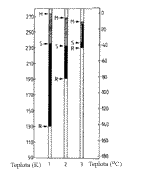
Obr.16 - přehled teplot významných při používání mrazicích metod |
| Zpět | |
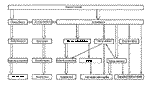 |
Obr.17 - schematické znázornění možných postupů přípravy preparátu pro TEM s využitím mrazících metod |
| Zpět | |
Tabulky | ||||
| Tab.1 - Vlastnosti nejčastěji používaných chladících médií (podle Robardse a Sleytra 1985) | ||||
| Kapalina | Bod tání (K) |
Bod varu (K) |
Specifické teplo (J/gK) |
Tepelná vodivost (mJ/msK) |
| Etanol | 156 | 352 | 1,9 | 206 |
| Isopentan | 113 | 301 | 1,7 | 182 |
| Etan | 90 | 184 | 2,3 | 240 |
| Propan | 84 | 231 | 1,9 | 219 |
| Kapalný dusík | 63 | 77 | 2,0 | 153 |
| Kapalné helium | 1,7 | 4,2 | 4,5 | 18 |
| Zpět | ||||